I. 서 론
II. 광음향 영상 원리
III. 암 진단을 위한 광음향 영상
3.1 광음향 영상을 이용한 암 진단 기술
3.2 광음향 조영제
IV. 광음향 영상을 이용한 감시림프절 판별
4.1 감시림프절의 판별 방법
4.2 광음향 영상기술을 이용한 감시림프절 판별
V. 결 론
I. 서 론
우리나라 사망원인의 1위를 차지하고 있는 암은 전체 사망률의 약 30 %를 차지하고 있으며 암으로 인한 사망률이 해마다 증가하고 있다.[1],[2] 세계보건기구(World Health Organization,WHO)는 암 발생의 1/3은 예방이 가능하고, 1/3은 조기진단을 통해 완치가 가능한 것으로 보고하고 있으며, 우리나라는 암 환자의 높은 생존율과 완치율을 위해 1996년부터 암 관리 사업을 시행하고 있다. 암 진단을 위해 사용되는 영상기기로는 X선 촬영(X-ray), 자기공명영상(Magnetic Resonance Imaging, MRI), 초음파(Ultrasound, US), 양전자방출 단층촬영술(Positron Emission Tomography, PET), 광학영상(Optical imaging), X-ray 등이 있다. 이러한 다양한 의료영상기기는 각자의 장단점을 가지고 있으며 최근에는 암과 같은 질병을 진단하기 위해 각 영상기기의 장점만을 융합한 의료영상기술에 대한 연구가 활발히 진행되고 있으며 그 중 광학과 초음파를 결합한 광음향 영상이 의료융합영상 기술의 하나의 예시이다.
초음파 영상은 실시간으로 영상 제공이 가능하며, 영상의 침투 깊이가 높고 효율적인 진단비의 장점을 가지지만 낮은 대조도로 인한 영상의 질이 떨어지는 단점이 있다.[3] 광학영상은 높은 공간해상도 및 대조도를 제공할 수 있는 장점을 가지나 낮은 영상 깊이(1 mm ~ 2 mm)의 단점을 가진다.[4] 이러한 두 영상기법의 융합을 통해 장점을 강화하고 단점을 보완한 기술이 광음향 영상기술이다.
광음향 영상은 높은 공간해상도와 깊은 조직(~ 7 cm)의 영상화가 가능하여 혈관 영상과 산소 포화도 측정에 활용가능하다.[5],[6],[7],[8],[9],[10] 또한 광음향 기술을 통해 조기 암 진단이 가능하며, 암 전이 여부까지 확인 할 수 있어 조기 진단 및 효율적인 치료가 가능하다. 본 논문에서는 광음향의 원리, 광음향 영상기술을 활용한 조기 암 및 전이 암 진단 방법과 조영제를 이용한 고대조도 광음향 및 초음파 영상에 대한 연구들을 소개한다.
II. 광음향 영상 원리
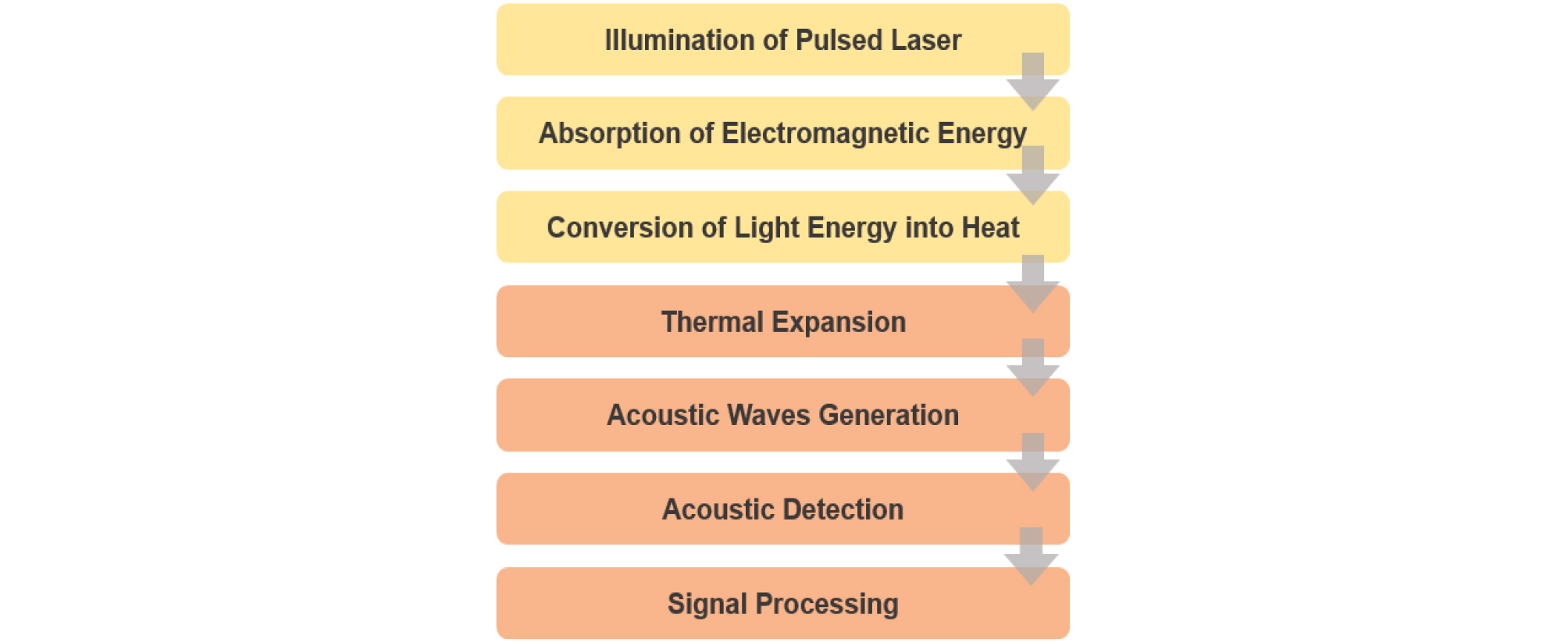
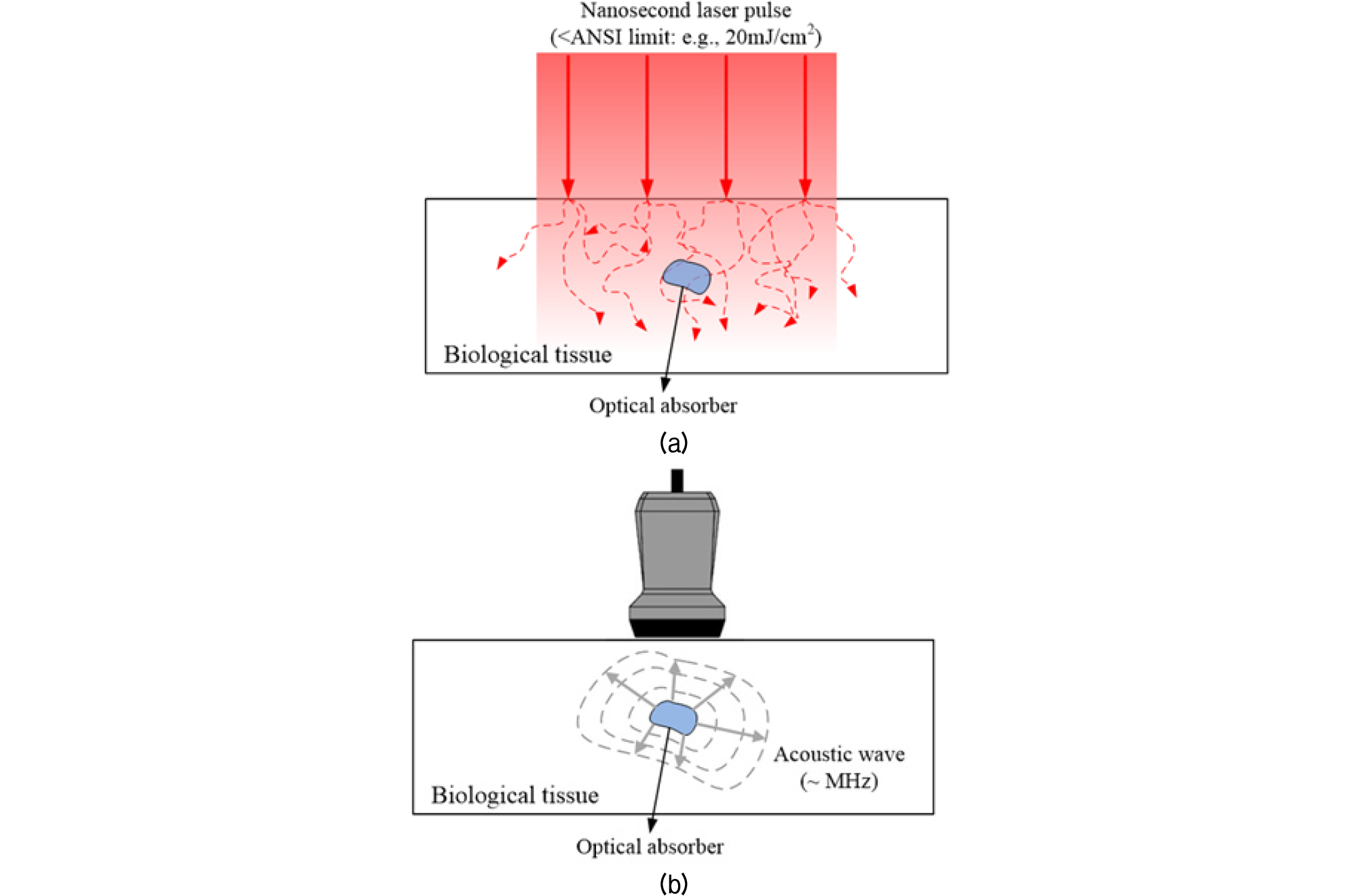
광음향 신호는 조사된 레이저 에너지를 흡수한 생체조직 내에서, 레이저 에너지가 열에너지로 변환되고 이때 발생하는 열팽창으로 생성되는 음향 신호를 말한다.[5] 이러한 과정을 광음향 효과라고 한다. 발생되는 광음향 신호는 수 MHz에서 수십 MHz의 초음파 주파수 대역을 갖게 되며, 초음파 영상에서 사용하고 있는 초음파 변환기를 사용하여 감지할 수 있다. 이렇게 감지된 신호는 여러 가지의 신호처리 과정을 거쳐 영상화가 이루어진다. Figs. 1과 2는 광음향 영상의 기본 원리를 도식화 한 것이다.
여러 종류의 분자들로 구성된 생체조직에서 광흡수 계수는 파장에 민감하여, 레이저의 파장에 따라 다른 레이저 에너지 흡수율을 가진다.[4] 이러한 특이성을 이용하여 원하는 특정 생체 조직에서 조사된 레이저 에너지를 상대적으로 더 많이 흡수하게 된다. 즉, 생체조직별로 각각의 다른 레이저 파장에서 발생하는 광음향 신호를 활용하여 영상화를 하게 되는 것이다.
광음향 신호의 효율적인 생성을 위해서 다음과 같은 두 가지의 조건을 만족해야한다.[5] 먼저, 레이저 펄스 길이는 열 완화 시간보다 짧아야 한다. 즉, 레이저 펄스 길이는 열의 확산 속도보다 짧아야 하며 이러한 조건을 열 제한 조건이라고 한다. 이를 위하여 레이저 펄스의 길이는 다음의 식을 만족하여야 한다.
| $$\tau_{th}\ll\frac{d_c^2}{4D_T},$$ | (1) |
여기서 τth는 열 제한 한계점, dc는 열이 발생되는 면적, DT는 열 확산계수를 의미한다.
두 번째 조건은 레이저 펄스 길이가 응력 완화 시간보다 짧아야하며 이러한 조건을 응력 제한 조건이라고 한다. 이러한 조건을 만족하는 레이저 펄스 길이는 다음의 식으로 구할 수 있다.
| $$\tau_{st}\ll\frac{d_c^{}}{v_s},$$ | (2) |
여기서 vs는 매질에서의 초음파 속도를 의미한다. 레이저 펄스의 길이는 위의 두 조건을 동시에 만족해야하며, 일반적으로 응력 제한 조건을 만족하면 열 제한 조건도 만족하게 된다. 만약, 조사한 레이저 펄스 길이가 열 제한 조건과 응력 제한 조건을 모두 만족할 경우 부피 팽창은 무시할 수 있을 만큼 작아지게 되며 열 팽창은 압력을 상승시키고 상승한 압력 P0는 아래의 식으로 구할 수 있다.[9],[10]
| $$p_0=(\beta c^2/C_p)\mu_aF=\Gamma A.$$ | (3) |
Eq. (3)에서 β는 K−1에서 등압 체적 팽창 계수, Cp는 비열(J/(K kg)), μa는 흡수 계수(cm−1), F는 국부 광에너지유량(local light fluence)(J/cm2), Γ는 그뤼나이젠 계수이며 A는 국부 에너지 증착 밀도(J/cm3)를 나타낸다.
위와 같은 과정으로 얻은 광음향 신호는 앞서 기술했듯이 넓은 주파수 대역(수MHz – 수십MHz)을 가지며 광음향 신호가 발생하는 생체조직의 크기에 따라 주파수 별 에너지 분포가 결정된다. 생체조직의 크기가 작을수록 신호의 에너지 분포는 고주파수 대역이 되며, 생체조직의 크기가 클수록 저주파수 대역에 에너지가 분포하게 된다.[11] 이러한 광음향 신호의 특징으로 인해 초음파 변환기는 넓은 주파수 대역의 신호를 수신할 수 있도록 광대역 특성을 가지며, 수신 특성 또한 우수해야한다. 따라서 초음파 변환기는 광음향 영상 신호의 신호 대 잡음비(Signal to Noise Ratio, SNR)를 극대화할 수 있는 변환기 개발이 필수적이다.
마지막으로, 광음향 영상은 영상 구성에 따라 PAM (Photoacoustic Microscopy), PAT(Photoacoustic Tomography) 및 CS-PAI(Cross-sectional Photoacoustic Imaging)로 분류할 수 있으며 각 영상 구성 방법에 대한 자세한 내용은 References [5-6, 12-13]에서 확인할 수 있다.
III. 암 진단을 위한 광음향 영상
3.1 광음향 영상을 이용한 암 진단 기술
광음향 영상은 유방암, 감시림프절 및 피부 병변과 관련된 질병을 진단하는 곳에 유용하게 사용되고 있다. 유방암의 경우, 유방 종양의 발달이 미세 석회화와 밀접한 관계를 가지므로 유방암의 조기 진단 시, 미세석회화병변 영상화가 가능한 X-ray 유방 촬영술을 사용하고 있다. 하지만 유방 촬영술은 유방 종양을 제거할 때, 실시간으로 종양을 관찰할 수 없고 이온화 방사선을 사용하여 환자에게 위험 부담을 주며 치밀 유방(dense breast)의 경우 높은 부정 오류의 결과를 제공하는 단점이 있다. 초음파 영상은 생검 시 실시간 영상 유도에 널리 사용되지만 미세석회화에 대한 낮은 대조도로 인해 효율적인 조기 암 검진이 어려운 단점이 있다. 이러한 문제점을 해결하기 위해 광음향 영상 기술을 활용하여 실시간으로 높은 공간 및 대조 해상도를 가지며 신체적 압박과 이온화 방사선의 위험 부담이 없는 유방암 진단에 대해 활발히 연구하고 있으며, 다양한 형태의 임상 시스템 개발이 진행되고 있다.[14],[15],[16],[17]
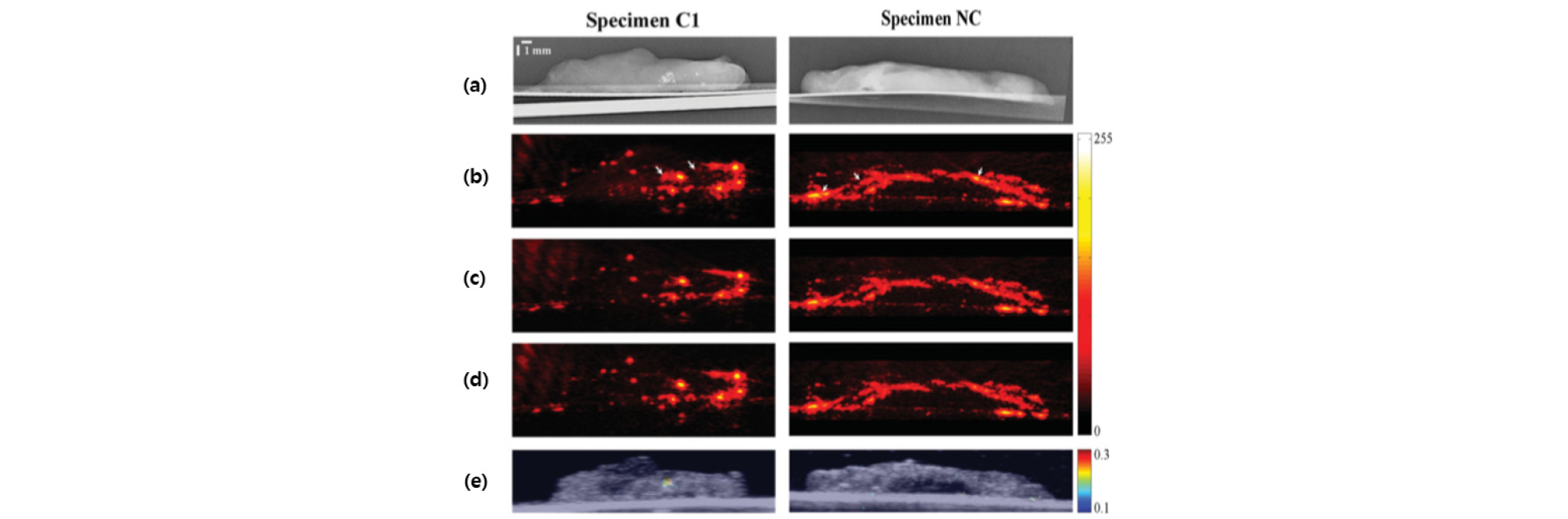
최근 조기 유방암 진단에 유용한 미세 석회화 조직에서의 광음향 신호 생성 여부를 검증하기 위해 유방 조직을 사용하여 광음향 신호 검출 실험을 수행하였다.[16],[18],[19] 본 실험에서는 레이저의 파장에 따른 미세석회화 조직의 광음향 신호를 측정하였으며, 690 nm ~ 700 nm 대역의 레이저를 조사할 경우 광음향 신호가 크게 발생하였고 레이저의 파장이 길어질수록 광음향 신호가 작아지는 것을 확인하였다. 이를 활용하여 광음향 영상 기반의 유방 미세석회화 병변 영상을 실시간으로 구성할 수 있음을 확인하였다. Fig. 3은 광음향 영상 기술을 활용하여 시편의 측방향에서 촬영한 미세 석회화 영상이다. Fig. 3(a)는 X-ray 유방 촬영술을 이용한 유방 조직을 보여주며 C1은 미세석회화 병변을 포함하는 유방 조직이며 NC는 미세석회화 병변이 없는 유방조직이다. 본 실험에서는 700 nm, 750 nm, 800 nm의 레이저 파장을 사용하였으며 Fig. 3(b)~(d)는 각 파장을 이용한 광음향 영상이다. Fig. 3(e)는 광음향 분광기법을 이용한 영상으로 X-ray 유방 촬영술과 광음향 영상에서 미세 석회화 병변의 위치가 일치하는 것을 확인할 수 있으며 이를 통해 광음향 영상이 유방암 조기 진단에 유용하게 사용될 수 있다는 것을 입증하였다.
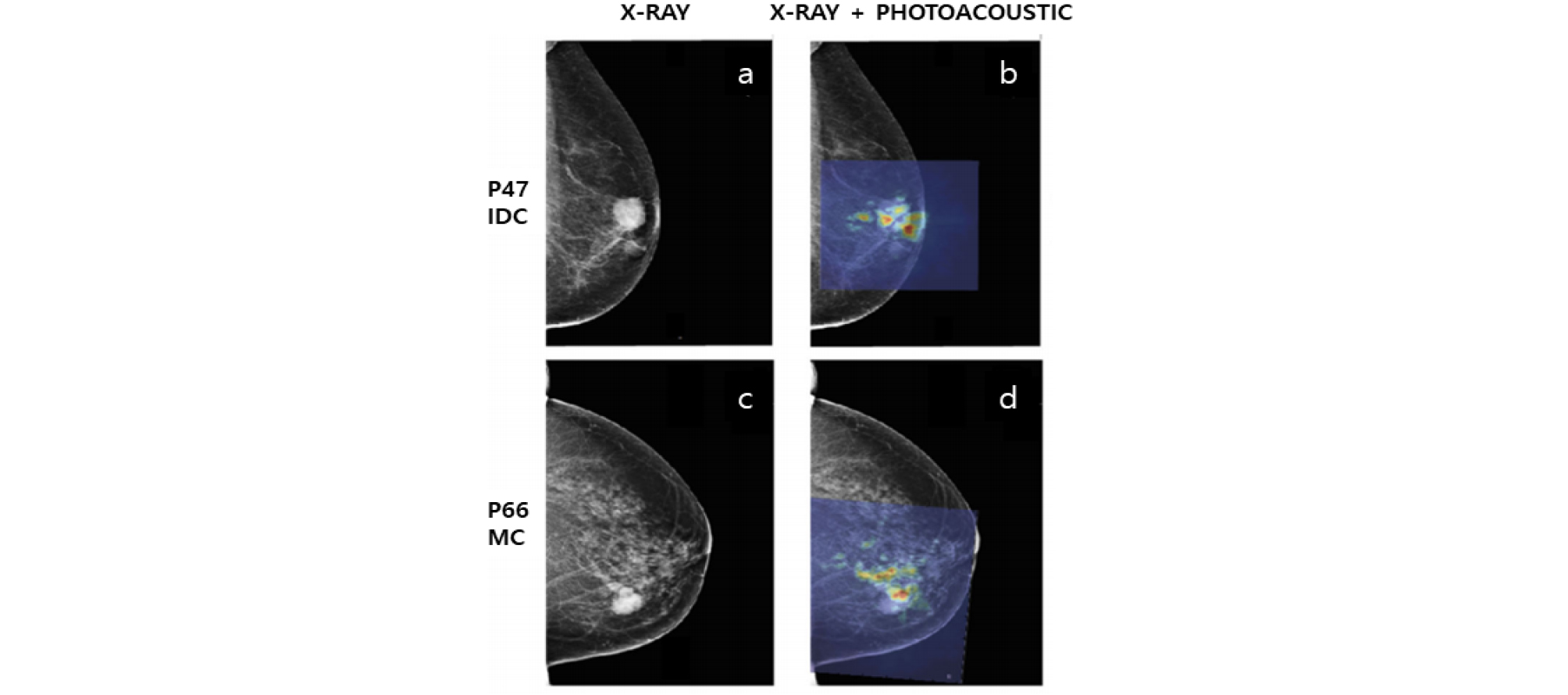
Fig. 4는 유방암 진단 전용 광음향 영상기기로 개발된 트벤테 광음향 매모스코프(Twente photoacoustic mammoscope)를 이용하여 획득한 광음향 영상을 보인 결과 영상이다.[20],[21] 개발한 시스템에서 환자의 유방은 시스템 상에서 레이저 조사를 위한 유리판과 초음파 어레이 변환기(590 elements, 1 MHz center frequency) 사이에 약간의 압박을 통해 고정되며 촬영 시 3차원 영상을 얻을 수 있다. 본 시스템을 이용하여 임상 실험을 진행한 결과 광음향 영상에서 더 높은 대조로 유방 악성 종양을 시각화 할 수 있음을 확인하였다.
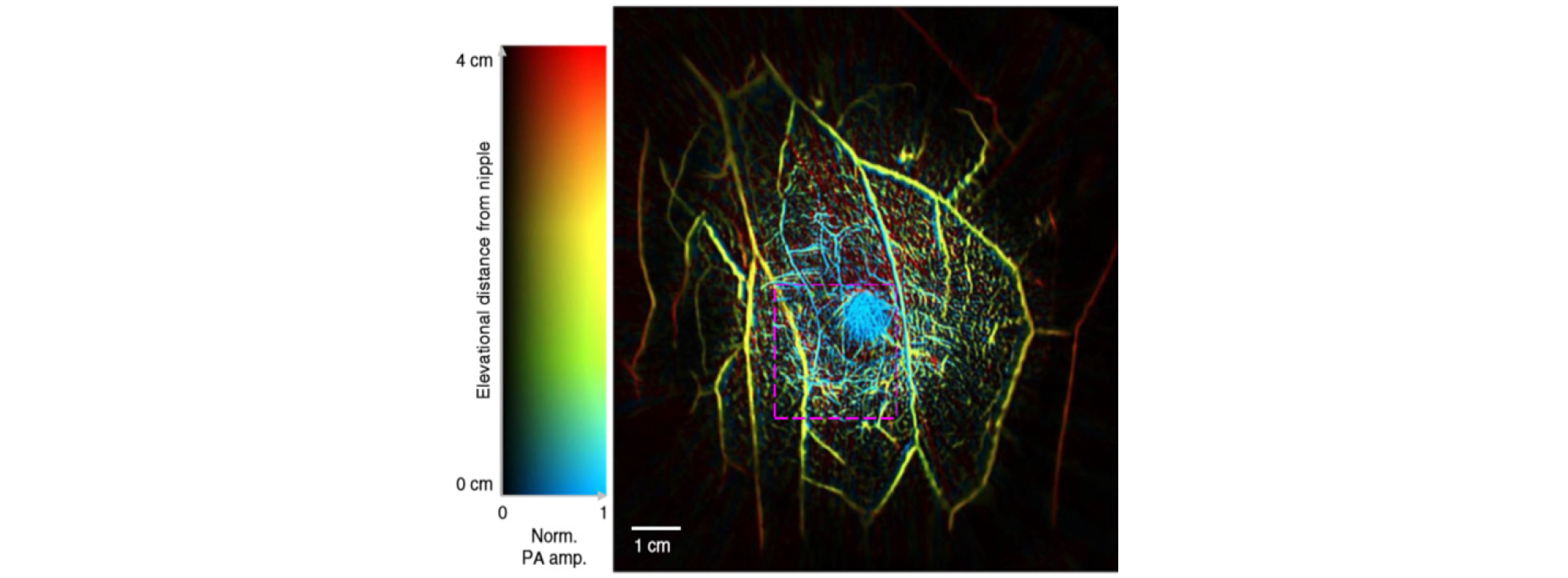
최근에 15 s 이내에 유방 전체의 3D 영상이나 유방의 2D 단면 영상을 얻을 수 있는 SBH-PACT(Single- Breath Hold PhotoAcoustic Computed Tomography) 시스템이 개발되었다.[17] 본 시스템에서는 링 형태의 변환기(512 elements, 2.25 MHz)를 사용하였으며 1064 nm의 레이저 파장을 이용하여 유방전체의 혈관을 영상화하였다. Fig. 5는 건강한 사람의 유방을 SBH- PACT로 촬영하여 깊이에 따른 색의 분포로 표현된 혈관 영상이다. 영상에서 보이는 것과 같이 SBH- PACT는 깊은 영역까지 영상화가 가능하고, 공간 및 시간 해상도가 높으며 전리 방사선 및 조영제 표지 기술(label) 없이 암 진단이 가능하다. 이러한 특징으로 종양과 관련된 밀도가 높은 혈관을 관찰하여 종양을 명확하게 판단할 수 있음을 보였다.
3.2 광음향 조영제
광음향 영상 기술은 조영제의 사용 없이도 암 진단을 위한 영상이 가능하지만, 더 높은 대조도를 위해 다양한 외인성 조영제들의 연구가 진행되고 있다. 광음향 영상에서 널리 사용되는 조영제인 금나노입자는 플라즈마 공명 주파수의 적색 편이가 일어나는 현상을 이용하여 영상화할 수 있으며, 형태에 따라 흡수 파장이 달라지는 성질을 가지고 있다.[22] 구 형태로 이루어진 Au NPs(Gold nanoparticles)는 2 nm ~ 60 nm의 크기로 520 nm ~ 540 nm의 흡수 파장을 가지며, 쥐의 조직에서 플라즈마-공명 커플링효과에 기초하여 높은 민감도의 광음향 영상을 통해 암을 검출 할 수 있음을 입증하였다. 막대 모양으로 이루어진 AuNR(Gold nanorod)는 가로 10, 세로 40 nm ~ 60 nm의 크기를 가지며, 650 nm ~ 1100 nm의 흡수파장을 가진다.[23] 열적 안정성을 가지는 SiO2-AuNRs (Slica-coated gold nanorods)는 다중 스펙트럼 광음향 영상 방법을 사용하여 이형세포조직 내에서 여러 유형의 세포를 식별 가능하게 하였다. 속이 비어있고 금으로 겉을 감싸는 형태로 개발된 HAuNS(Hollow gold nanosphere)은 지름이 40 nm ~ 45 nm이고 두께는 2.5 nm로 이루어져있다.[24] HAuNS는 근적외선 범위에서 강한 흡수 공명을 나타내며, 이때 파장은 800 nm로 혈액보다 높은 광음향 효율을 보인다. PEG- HAuNS(Pegylated Hallow gold nanosphere)은 높은 공간 해상도와 민감도를 제공하며, 광음향 영상을 통해 직경이 약 100 micro m인 뇌혈관을 명확하게 볼 수 있음을 보였다.
근적외선 영역에서 강한 광 흡수를 가지며 식품 의약품 안전청의 승인 염료인 ICG(Indocyanine Green)가 내장된 ICG PEBBLEs(ICG-embedded ormosil PEBBLEs)은 100 nm의 크기를 가지며 790 nm의 흡수파장을 가진다.[25] ICG PEBBLEs는 유방암 및 전립선 암 세포 표적화를 위한 HER-2 항체와의 접합을 통해 전립선 암세포 검출에 사용되었다. 지름이 600 nm인 ICG- loaded PFC(perfluorocarbon) nanodroplet은 초음파 및 광음향 다중 조영제로 개발되었다.[26] 레이저 에너지에 의해 활성화된 PFC nanodroplet은 위상 전이를 통해 마이크로 사이즈의 버블로 변화하면서 강한 광음향 신호를 발생한다. 또한 마이크로 버블은 주위 조직 및 혈액과의 음향 임피던스 차이를 통해 향상된 초음파 영상의 대조도를 제공하였다. SWNT(Single- Walled carbon Nano Tube)은 지름 1 nm ~ 2 nm, 길이 50 nm ~ 300 nm, 흡수 파장이 690 nm이고 살아있는 동물의 분자 표적에 결합하는 특징을 가지며 매우 높은 광음향 신호를 발생한다.[27] 이러한 특징을 가진 SWNT는 종양 혈관계에서 과다 발현되는 αvβ3 인테그린(integrin) 영상화를 위해 사용되며 cyclic Arg-Gly-Asp (RGD) Peptide와 SWNT-ICG를 결합을 통해 αvβ3 인테그린 표적화를 위한 SWNT-ICG-RGD을 개발되기도 하였다.
IV. 광음향 영상을 이용한 감시림프절 판별
4.1 감시림프절의 판별 방법
암으로 인한 사망의 90 % 이상은 원발 종양 보다 전이 때문에 발생하게 된다. 암세포는 자라면서 영양 공급을 위해 새로운 혈관과 림프관을 생성하며, 전이가 시작될 때 암세포가 가장 먼저 도달하는 곳이 감시림프절이다. 감시림프절의 암세포 유무는 가장 중요한 예후인자로써 암 전이 여부판단을 위한 기존의 표준 검출 및 치료 방법으로 액와 림프절 절제술을 수행하였다. 하지만 광범위한 부위의 절개가 필요한 액와 림프절 절제술은 무감각, 림프 부종, 상체 움직임의 제한과 같은 합병증의 유발 가능성이 있다.[28] 이러한 문제점을 해결하기 위해 합병증의 발생을 줄일 수 있는 국소 부위 절제를 위한 감시림프절 생검이 많이 수행되고 있다.[29]
감시림프절 생검의 정확성을 높이고 최소 침습을 위해 여러 가지 영상방법이 사용되고 있다. 그 중 대표적인 영상 시스템의 특징이 Table 1에 요약되어있다. LS(Lymphoscintigraphy)는 수술 전 감시림프절의 영상화에 사용되는 대표적인 기법으로 감마선 핵종을 사용하여 림프절의 영상을 획득한다.[30] 하지만 환자의 높은 방사능 노출 위험이 있고 낮은 공간해상도의 단점을 가진다. MRI은 방사선 물질을 사용하지 않으며 높은 공간 해상도를 제공하지만 높은 진단비와 감시림프절의 미세전이 판별 정확성이 떨어지는 한계점을 가진다.[31] 높은 공간해상도의 영상을 실시간으로 제공이 가능한 초음파는 수술 중에도 사용가능한 장점을 가지지만 감시림프절의 형태 파악만 할 수 있으며 낮은 정확도를 가지는 단점이 있다.[32]
Table 1. Features of imaging systems used for sentinel lymph node biopsy.
| Method | Ionization Radiation | Image depth | Spatial resoluation | Performance |
| LS | YES | deep | 20 mm | Preoperative |
| MRI | NO | deep | 10~100 𝜇s | Preoperative |
| US | NO | ~ 20 cm | 400 𝜇s | Preoperative & Intraoperative |
4.2 광음향 영상기술을 이용한 감시림프절 판별
전술한 것과 같이 다양한 영상 시스템이 감시림프절의 영상 검출을 위해 사용되고 있지만 합병증의 문제를 최소화하기 위해서는 최대한 적은 생검 횟수와 감시림프절의 정확한 위치 추적이 요구된다. 이러한 요구사항의 충족을 위해 높은 해상도, 깊은 조직의 영상과 조영제에 대한 높은 민감도를 가지며 안정한 방법으로 실시간 영상화가 가능한 의료영상 기법이 필요하며 최근 광음향 영상을 이용한 감시림프절 판별에 대한 가능성이 연구되고 있다.
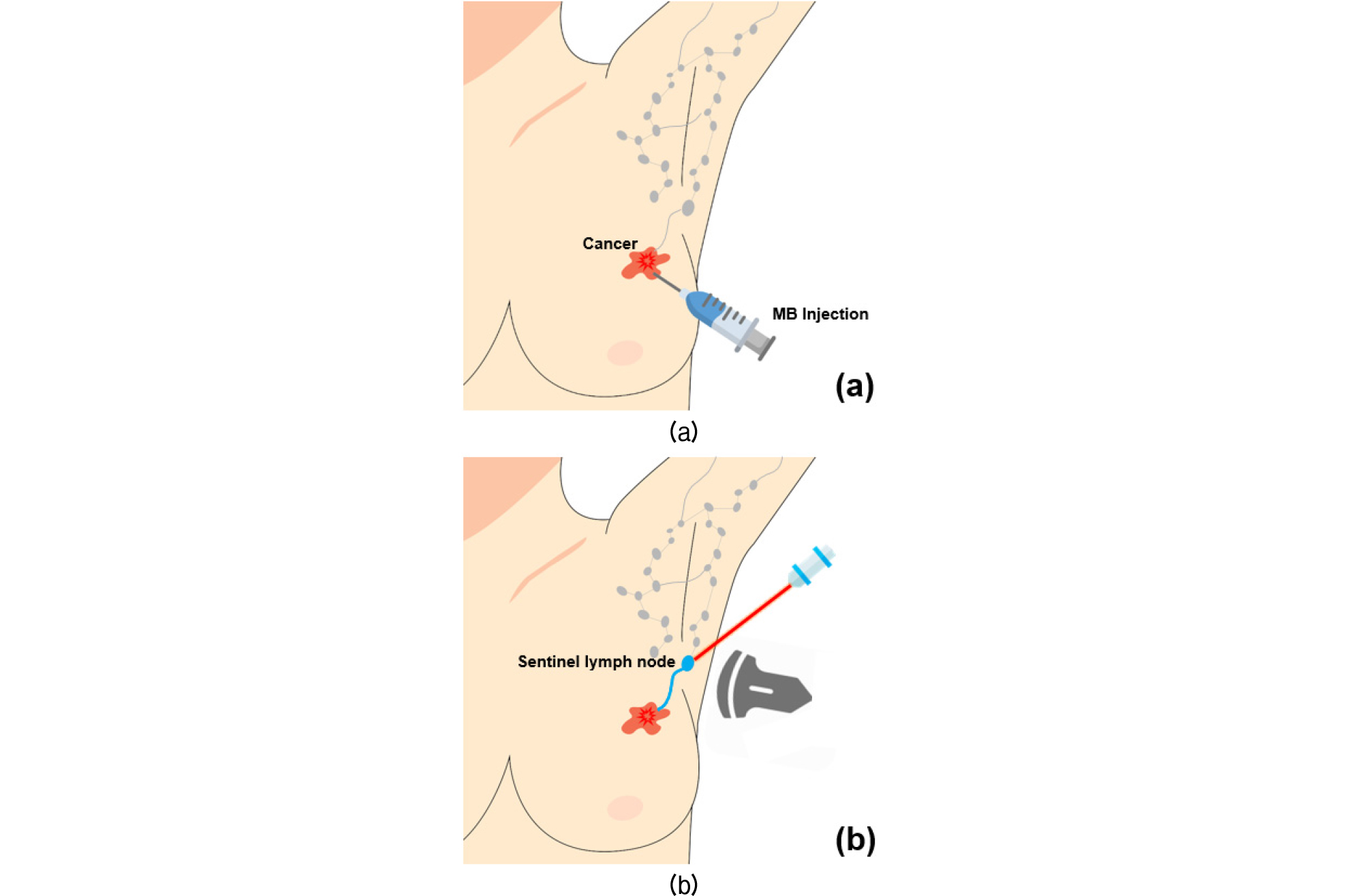
광음향 영상을 이용한 감시림프절 생검의 순서는 Fig. 6에 묘사되어있다. 기존 감시림프절 생검과 같이 암 주변에 조영제를 피하 주사한 후, 감시림프절에 레이저를 조사하여 광음향 신호를 발생시키고 이를 영상화 한다. 감시림프절 판별에 사용된 조영제는 부작용의 최소화를 위해 식품 의약품 안전청에서 승인을 받은 MB(Methylene Blue)와 ICG를 조영제로 사용하였다.[33],[34] MB와 ICG는 각각 최대 30 mm, 22 mm의 깊이에 위치한 감시림프절의 영상을 얻을 수 있었지만 농도에 따른 광음향 신호의 차이와 높은 유속으로 인해 시간이 지날수록 추적의 어려움이 있으며 이러한 문제점을 해결하기 위해 다양한 조영제들이 연구되고 있다.
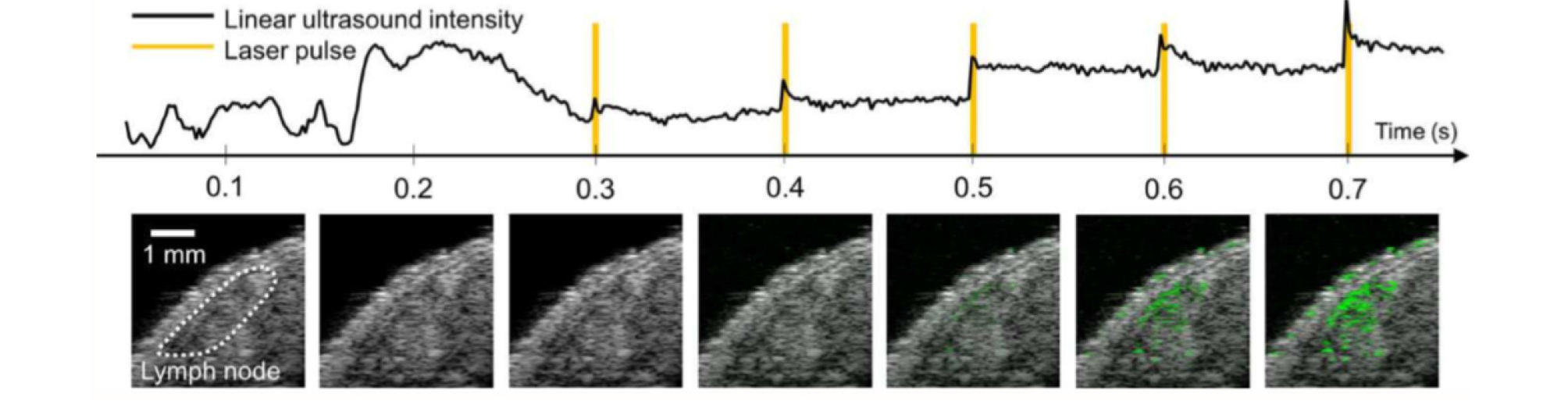
Si-AuNP(Silica-coated gold nanoplates)는 낮은 세포독성과 강한 유지력으로 기존의 지속력이 약한 조영제의 대안을 제공한다.[35] 금 기반 입자로 이루어진 Si-AuNP는 원하는 레이저 파장에서 높은 광학 흡광도의 조정이 가능하고 레이저 조사에 노출 될 때 높은 광열 안정성을 보여 생체 내 광 음향 영상에 적합한 조영제이다. 이외에 상변화의 특징을 이용한 나노미터 크기의 조영제(laser-activated nanodroplets, LAND)는 액체 상태의 과불화탄소(perfluorocarbon)가 레이저 조사에 의해 기화되면서 미세 기포상태로 상변화를 일으킨다.[36],[37] 상변이가 일어남과 동시에 높은 신호의 광음향 신호가 발생하며 상변이된 나노입자는 마이크로 사이즈의 버블이 되어 초음파를 통해 영상화가 가능하여 LAND는 다중 조영제로써 사용이 가능하다. Fig. 7은 LAND를 사용하여 감시림프절의 위치를 확인할 수 있음을 동물 실험을 통해 보인 결과 영상이다.
위와 같은 조영제를 사용하면 감시림프절의 위치의 정확도를 높이는 영상을 얻을 수 있다. 하지만 조영제 주입으로 인한 부작용을 없애기 위해 분광 광음향 영상(Spectroscopic PA Imaging)을 사용하여 림프절의 산소포화도를 측정함으로써 전이를 진단하려는 시도가 있었다.[38] 이 연구를 통해서 전이된 림프절이 정상 림프절보다 산소포화도가 낮다는 연구 결과가 밝혀졌으나, 적은 수의 암세포가 혈중 산소 포화도에 영향을 미치지 않을 수 있기 때문에 초기 단계의 암 진행에서 미세전이의 진단여부가 확실하지 않은 단점이 존재하지만 조영제비표지(label-free) 기술로 전이여부를 판단할 수 있는 가능성을 제시하였다.
V. 결 론
암 진단을 위한 기존 영상 시스템의 단점을 보완한 광음향 영상은 실시간으로 높은 공간해상도의 영상화가 가능하여 암 진단과 감시림프절 판별에 적합하다. 더 높은 해상도와 안정도를 위한 조영제가 개발되고 있으며, 이를 통해 암 초기단계의 미세 전이 진단까지도 가능할 것이다. 현재까지는 소동물을 대상으로하는 전임상 연구가 주를 이루었으나 최근에 광음향 영상의 임상적용에 대한 연구가 활발히 이루어지면서 새로운 임상 분야 개척 및 시스템 개발이 따를 것으로 예상된다.
하지만 광음향 영상 시스템을 실제 임상에 적용하기 위해서는 고감도의 초음파 변환기 개발 및 빛의 산란으로 인한 해상도 저하 문제해결 등에 대한 연구가 선행되어야 한다. 또한 레이저의 안전 문제 해결 및 저비용의 레이저 개발이 필요하다. 이러한 요소 기술들이 확보된다면 광음향 영상 기술을 이용한 암 진단의 임상적 활용 범위가 넓어질 것으로 예상된다.